尽管Millar压力导管主要设计用于测量高精度的心血管压力,但这些传感器已用于测量体内一系列其他生理压力,例如肿瘤间质液,气道和脊柱(椎间盘)压力。尽管Millar压力导管主要设计用于测量高精度的心血管压力,但这些传感器已用于测量体内一系列其他生理压力,例如肿瘤间质液,气道和脊柱(椎间盘)压力。
在此,我们讨论压力导管的一些鲜为人知的应用,包括为什么以及如何在这些不同区域中测量压力,及助您入门的有用资源!
#1肿瘤间质液压力
|
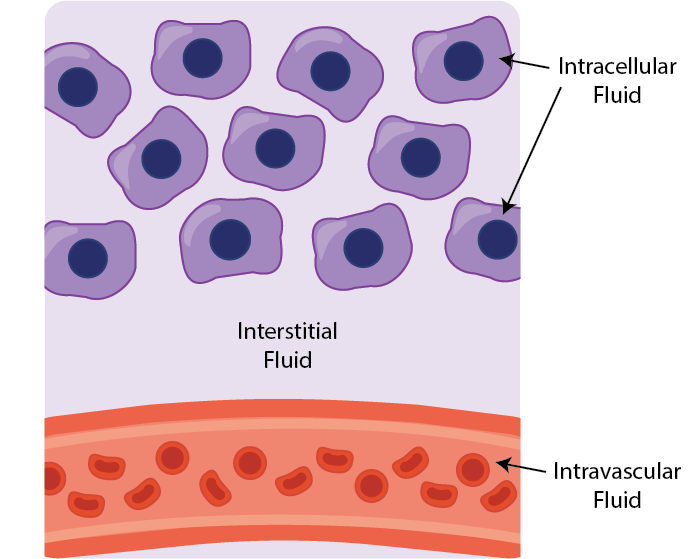
从概念上讲,体液可以分为三个主要的液腔:血管内,间质和细胞内。 间质液(组织液),位于组织细胞之间,约占人体体积的六分之一,在血管系统和细胞之间的氧气,营养物质和废物交换中起着至关重要的作用。 水和分子在这些腔室中的运动,也称为跨毛细血管流动,是由毛细血管和周围组织中的液体和蛋白质施加的静水张力和渗透张力(或压力梯度)调节的。1 通常,间质液压力(IFP)是通过基质细胞和细胞外基质分子的相互作用来调节的。然而,通常在实体肿瘤内,IFP明显高于正常情况,从而形成了阻碍有效药物进入肿瘤的屏障。1了解IFP的升高如何影响药物渗透到各种肿瘤中是癌症生物学的基本特征。 |
体内有三个主要的液腔: 血管内,间质和细胞内 |
通过体内监测肿瘤IFP,研究人员已经能够观察到肿瘤生长,IFP增加和减少治疗反应之间的相关性。迄今为止,小鼠是癌症研究中最常用的动物模型,从而导致了一系列成熟的直接和间接测量肿瘤IFP的方法。直接方法测量压力的高低。相反,通过计算机算法或比例因子,间接方法测量的定量值可用于得出肿瘤压力。2
下面我们将看一看用于癌症研究的IFP的直接测量。
如何测量肿瘤IFP?
通常,可以通过将测量探针直接插入肿瘤组织中来测量肿瘤IFP。两种最常用的测量肿瘤压力的方法是吸针法和压力导管法。
但是,压力导管法具有检测IFP和实体压力的额外优势。是确定肿瘤确切IFP的重要因素。2
它包括将校准过的压力导管插入麻醉动物的肿瘤中。通常,首先使用导针穿透目标肿瘤或组织; 然后拔出针头,插入导管探头。
将导管连接到桥式放大器和PowerLab数据采集系统以采集压力信号。然后可以在LabChart软件中可视化和分析压力信号。Millar导管提供了一种简单,精确的方法来记录各种模型中的肿瘤间质液压力。Millar的SPR-1000,SPR-320和SPR-524压力导管均已用于提供高质量的肿瘤IFP测量(请参见下面的文献)。
引用Millar技术进行IFP测量的文献:
- A simple method for measuring interstitial fluid pressure in cancer tissues (2005) - SPR-320导管
- Enzymatic Targeting of the Stroma Ablates Physical Barriers to Treatment of Pancreatic Ductal Adenocarcinoma - SPR-1000导管
- Antifibrotic Therapy Disrupts Stromal Barriers and Modulates the Immune Landscape in Pancreatic Ductal Adenocarcinoma (2019) - SPR-1000导管
- Interstitial Pressure in Pancreatic Ductal Adenocarcinoma Is Dominated by a Gel-Fluid Phase (2016) - SPR-1000 or SPR-671导管
#2 跨膈压力
|
膈肌位于肺和心脏下方,在呼吸过程以及清理气道行为(例如咳嗽,呕吐和打喷嚏)中起着至关重要的作用。它通过产生不同强度的张力(通过肌肉收缩和放松)来辅助通气和非通气行为,这可以通过测量跨膈压力来定义。3 了解损伤和疾病(例如神经肌肉疾病)如何影响膈肌产生张力完成各种功能时,跨膈压力尤其重要。 |
|
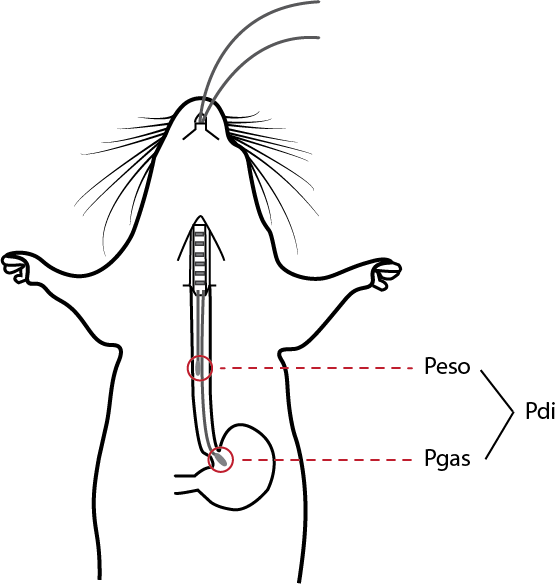
已经在一系列物种的研究中测量过跨膈压力,包括人类(临床),绵羊,狗,兔子,大鼠和小鼠。 传统上,在较大的受试对象中,使用一个双球囊导管系统测量跨膈压,将球囊末端的导管通过鼻子插入食道和胃,分别测量食道压力(Peso)和胃压(Pgas)。4 然后可以从这两个压力信号之间的差值得出跨膈压力。 近年来,研究已将固态压力导管用于该技术,这在较小的动物中特别有用,例如小鼠,很难插入球囊。3 |
测量小鼠跨膈压力(Pdi)的示意图 |
如何测量跨膈压力?
对于此技术,将两根压力导管(例如3.5 F,SPR-524 Millar导管)通过麻醉小鼠的食道插入,一个在胃中测量胃压力(Pgas),另一个在食道中测量食道压力(Peso)。来自导管的信号通过桥式放大器连接到PowerLab数据采集系统。可以在LabChart中分析压力信号,并且可以根据Pgas和Peso之间的差值自动计算跨膈压力。
此外请注意,根据动物的种类,大小以及两个压力部位之间所需的间距,还可以使用两种大鼠双压力导管:2.5F,SPR-721和2.5F,SPR-940。
请查看以下文献获取更多详细信息,有关如何使用Millar压力导管测量跨膈压力。
引用Millar技术(SPR-524导管)测量跨膈压力的文献:
- Functional Measurement of Respiratory Muscle Motor Behaviors using Transdiaphragmatic Pressure (2017)
- Novel method for transdiaphragmatic pressure measurements in mice (2013)
- Functional impact of diaphragm muscle sarcopenia in both male and female mice (2015)
- Impact of Unilateral Denervation on Transdiaphragmatic Pressure (2016)
#3脊柱或椎间盘压力
|
从字面上看,脊柱是身体的支柱-没有它,您将无法进行简单的动作,例如走路,弯腰或捡东西。脊柱的另一个重要功能是保护脊髓和相关的神经根,使您的大脑和身体的其余部分相互交流。 测量椎间盘应力或压力可以为您提供有关各种负荷作用在整个脊柱上的信息。当研究诸如神经退行性疾病,脊柱侧弯,椎间盘突出症或脊髓损伤等情况时,这尤其重要,这些疾病会影响脊柱上各种应力或负荷的分布方式。动物模型(例如绵羊)在该领域中特别有用,因为它们的脊柱形状与人类相似。 |
 |
如何测量椎间盘压力?
|
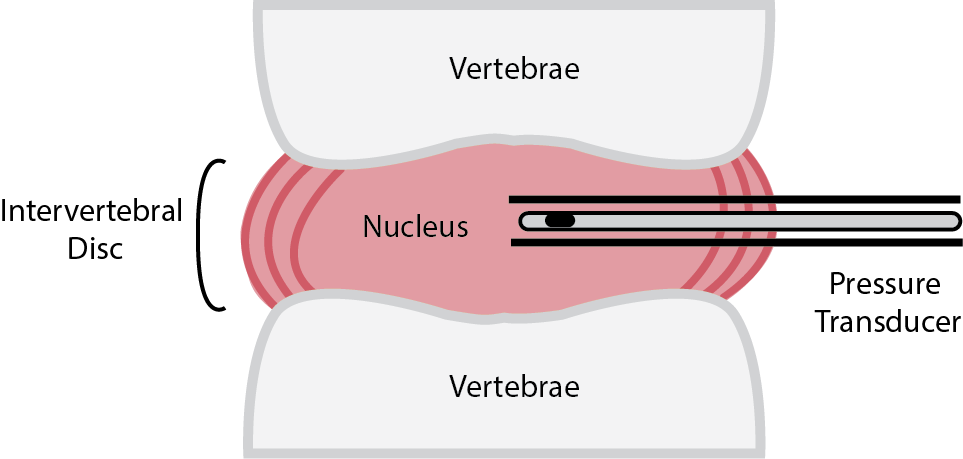
将压力传感器插入椎间盘髓核来监测椎间盘压力,一种方法是在开放式手术中直接插5,另一种是使用一根内部装有合适的Millar压力传感器的保护性腰穿针(如右图所示)。6 之所以可以这样做,是因为Millar微型压力导管可以承受从-760 mmHg至4000 mmHg的压力,并具有-50 mmHg至300 mmHg的线性响应,因为它们的主要用途是测量血压。但是,椎间盘压力通常在1000-3000 mmHg的范围内,比通常的血压范围高得多,因此压力测量必须在传感器的非线性量程内进行。
|
测量椎间盘内压力的示意图 |
- Effects of chondroitinase ABC on intradiscal pressure in sheep (2001) - SPR 407导管
- Effect of cervical spine fusion on adjacent-level intradiscal pressure and segmental motion (2002) - SPR 524导管
Millar 研究导管–精度造就先进技术
|
MillarMikro-Tip® 压力导管为测量高精度压力提供了理想的解决方案。无论是测量动脉和心室血压,脊柱压力,肿瘤压力还是气道压力,Millar 的高保真压力传感器都是您研究的必要条件。 我们提供多种尺寸的Millar导管,从用于大型动物(狗,猪或绵羊)的5 F导管到用于小鼠研究的世界上最小的1 F导管。 |
 |
通过将Millar的高灵敏度,微创导管与PowerLab数据采集和LabChart数据分析软件的精度相结合,您可以构建高质量,灵活的系统,为您提供值得信赖的完整数据。
有关我们的有创压力测量解决方案的更多信息,请联系我们!
其他资源:

1. Heldin, C., Rubin, K., Pietras, K. et al. High interstitial fluid pressure — an obstacle in cancer therapy. Nat Rev Cancer 4, 806–813 (2004) doi:10.1038/nrc1456
2. Kim, H., Yu, A.R., Lee, J.J. et al. Measurement of Tumor Pressure and Strategies of Imaging Tumor Pressure for Radioimmunotherapy. Nucl Med Mol Imaging 53, 235–241 (2019). https://doi.org/10.1007/s13139-019-00598-7
3. Greising, S. M., Sieck, D. C., Sieck, et al. Novel method for transdiaphragmatic pressure measurements in mice. Respiratory physiology & neurobiology, 188(1), 56–59 (2013). https://doi.org/10.1016/j.resp.2013.04.018
4. ATS/ERS Statement on respiratory muscle testing. Am J Respir Crit Care Med. 2002;166:518–624.
5. Takahashi, K., Shima, I., Porter, R.W. Nerve root pressure in lumbar disc herniation. Spine 24, 2003-2006 (1999). doi: 10.1097/00007632-199910010-00007
6. Sasaki, M., Takahashi, T., Miyahara, K., Hirose, T. Effects of chondroitinase ABC on intradiscal pressure in sheep. Spine 26, 463-468 (2001).