您是否正在考虑在您的神经科学研究中使用光遗传学,但不确定从哪里开始?在这里,我们概述了光遗传学中涉及的关键工具和技术及其在神经科学领域的应用。
什么是光遗传学?
光遗传学是神经生物学领域中一种相对较新的技术,它整合了光(光学)和基因工程的使用来操纵神经活动。它广泛涉及用光敏蛋白(视蛋白)转染神经元,根据使用的视蛋白类型,可以使用可见光脉冲选择性地激活或沉默这些神经元。
光遗传学现在已经在神经科学领域占据一席之地,并彻底改变了我们研究大脑的方式。在其应用之前,科学家们很难区分参与某些生理反应和行为的神经通路。替代方法(例如药理学或电刺激)缺乏可通过光遗传学工具实现的相同时间和解剖精度。
随着 相关技术,的快速发展 光遗传学为治疗性应用打开了大门,例如用于治疗帕金森病的深部脑刺激、预防癫痫发作,甚至用于心功能不全的心肌起搏。
光遗传学提供了一种高度针对性的神经调节方法,从活组织中单个神经元到自由活动的动物 - 使其成为神经科学研究人员的强大工具。
那么它是怎样工作的?
尽管现在有很多技术都属于光遗传学范畴,但通常它们可以分为两大类:用于在靶组织中表达视蛋白的工具,以及用于刺激(激活/去激活细胞)和测量产生的反应的工具。
该视频概述了用于在体动物研究的视蛋白表达和刺激的一些工具和技术,我们将在下面详细介绍。
视蛋白在靶组织中的表达
由于微生物视蛋白不是在哺乳动物组织中自然表达的,因此必须对靶细胞进行基因工程以表达这些蛋白质。
有几种技术可用于将视蛋白引入活细胞,包括 DNA 转染、电穿孔和转基因表达系统。在大脑中,病毒介导的基因传递已成为大多数神经科学家们的首选方法,因为它能够以更高的准确性靶向脑组织的不同区域。
病毒表达系统有三个主要组成部分:
- 视蛋白 - 光敏蛋白
- 启动子 - 用于靶向特定细胞类型
- 报告子 - 用于检测和量化蛋白质表达量,例如绿色荧光蛋白 (GFP)
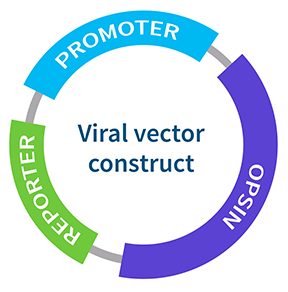
这些部分中的每一个都可以根据特定的研究问题进行定制。例如,有数百种不同类型的视蛋白变体可用,每种都有自己独特的光谱和动力学特征,可用于靶向不同的细胞类型并引发不同的生理反应(图 1)。
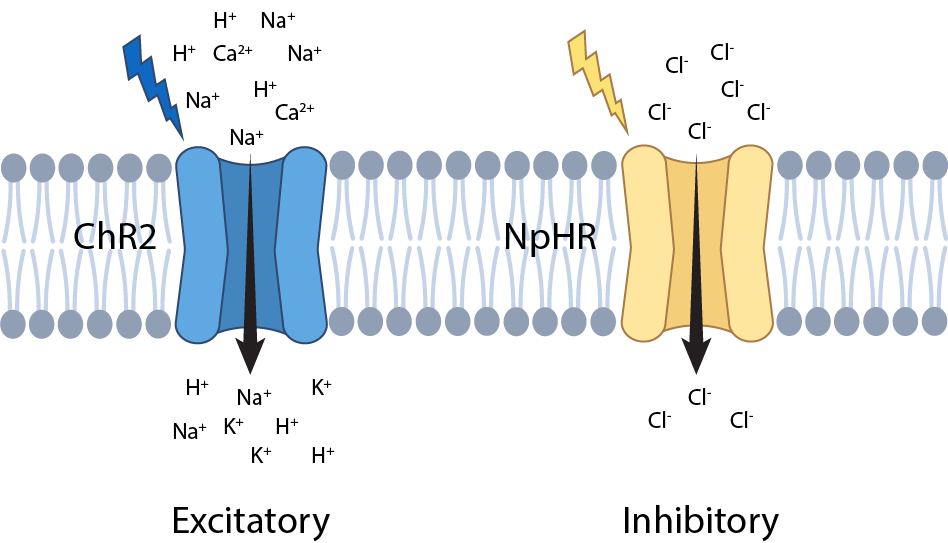
图 1. 不同视蛋白变体的范例。暴露于蓝光后,通道视紫红质2 (ChR2) 允许阳离子进入细胞,引起兴奋反应。相反,嗜盐菌视紫红质 (NpHR) 在暴露于黄光后会产生抑制反应。
例如,通道视紫红质是一种常用的“兴奋”视蛋白变体,在蓝光下可激活细胞。而嗜盐菌视紫红质是一种抑制型视蛋白,它在黄光下允许负离子流入细胞,抑制神经元活动。
同样,光遗传学工具包中有各种病毒表达系统,每个系统都设计用于不同的动物模型或促进不同类型的视蛋白表达。
腺相关病毒 (AAV) 是小动物研究中使用最广泛的病毒载体,因为与其它病毒载体相比,它具有对感染神经组织的特异性和相对较低的炎症率。
一旦构建并扩增了病毒载体,通常使用显微注射将病毒递送到大脑中的目标区域。然后病毒将感染局部神经元并传递构建体。这些神经元的一个选定亚群将具有正确的细胞机制来激活启动子并在细胞中表达视蛋白。
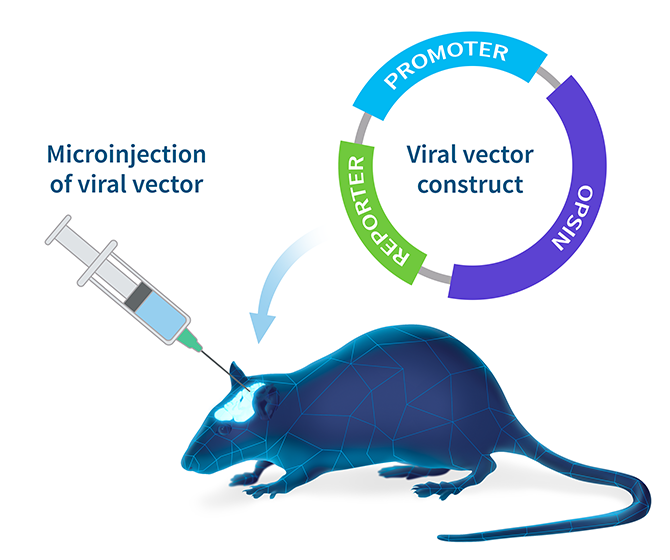
想了解更多详细信息关于病毒载体表达系统,以及创建和分离用于光遗传学研究的病毒载体的步骤,请查看这份 有用的指南。
光刺激视蛋白表达细胞
光遗传学研究需要考虑的第二个主要因素是刺激视蛋白表达细胞和测量产生的反应所需的工具。 大多数可用于 在体 动物研究的光靶向设备都使用系绳或无线头戴式系统,并增加了用于记录生理反应的辅助设备。
自光遗传学最初应用以来,线缆式和头戴式系统有了显著改进,但它们仍然有局限性,包括:
- 接口部位感染的可能性增加
- 影响正常的生理和行为(由于外连线缆或笨重的头戴设备)
- 电池寿命限制了实验持续时间和步骤
- 外连线缆维护和更换的额外费用
遥测光刺激
随着光遗传学现在转向治疗研究应用,需要更适合长期研究的光传递/刺激工具。因此,无线遥测系统在在体动物研究中变得越来越流行,因为能在居住环境中对动物进行长期、无限制的实验。
介绍 Kaha Sciences 光遗传学植入子
The Kaha 光遗传学植入子是第一个完全可植入的无线光遗传学解决方案,可在同一设备内提供光遗传学刺激和记录(EEG、ECG 和 EMG)。植入子专为大鼠设计,对希望在长期实验中应用光遗传学刺激步骤并记录定量生物电数据的研究人员来说,是一个理想的解决方案,不受电池电量和外连线缆的限制。
Kaha Sciences 光遗传学植入子 (TR58AB)
有关 Kaha 光遗传学植入子的更多信息以及它对您的特定研究应用有什么帮助,请与您 区域的 ADInstruments 代表联系。
请注意,ADInstruments 无法支持客户开发用于视蛋白表达的病毒载体。如果您不熟悉光遗传学,我们建议您与技术经验丰富的研究人员合作创建病毒载体表达系统。
有用的资源:
Optogenetics: 10 years of microbial opsins in neuroscience. Deisseroth, K. (2015). Nat Neurosci 18, 1213–1225. https://doi.org/10.1038/nn.4091
A Hitchhiker’s Guide to the Selection of Viral Vectors for Optogenetic Studies. Thompson K.R., Towne C. (2018). In: Stroh A. (eds) Optogenetics: A Roadmap. Neuromethods, vol 133. Humana Press, New York, NY. https://doi.org/10.1007/978-1-4939-7417-7_1
Making Sense of Optogenetics. Guru, A., Post, R. J., Ho, Y. Y., & Warden, M. R. (2015). The international journal of neuropsychopharmacology, 18(11), pyv079. https://doi.org/10.1093/ijnp/pyv079
The development and application of optogenetics. Fenno, L., Yizhar, O., & Deisseroth, K. (2011). Annual review of neuroscience, 34, 389–412. https://doi.org/10.1146/annurev-neuro-061010-113817
Optogenetics: controlling cell function with light. Pastrana, E. (2011). Nat Methods 8, 24–25. https://doi.org/10.1038/nmeth.f.323
